Brasilien ist der weltweit größte Niobproduzent und verfügt über etwa 98 Prozent der aktiven Reserven auf dem Planeten.Dieses chemische Element wird in Metalllegierungen, insbesondere hochfestem Stahl, und in nahezu unbegrenzten High-Tech-Anwendungen von Mobiltelefonen bis hin zu Flugzeugtriebwerken verwendet.Brasilien exportiert den Großteil des von ihm produzierten Niobs in Form von Rohstoffen wie Ferroniob.
Ein weiterer Stoff, über den Brasilien ebenfalls in großen Mengen verfügt, der aber zu wenig genutzt wird, ist Glycerin, ein Nebenprodukt der Öl- und Fettverseifung in der Seifen- und Waschmittelindustrie sowie von Umesterungsreaktionen in der Biodieselindustrie.In diesem Fall ist die Situation noch schlimmer, da Glycerin oft als Abfall entsorgt wird und die ordnungsgemäße Entsorgung großer Mengen komplex ist.
Eine an der Federal University of the ABC (UFABC) im brasilianischen Bundesstaat São Paulo durchgeführte Studie kombinierte Niob und Glycerin in einer vielversprechenden technologischen Lösung für die Herstellung von Brennstoffzellen.Ein die Studie beschreibender Artikel mit dem Titel „Niobium steigert die elektrokatalytische Pd-Aktivität in alkalischen Direktglycerol-Brennstoffzellen“ ist in ChemElectroChem veröffentlicht und auf dem Cover der Zeitschrift abgebildet.
„Im Prinzip funktioniert die Zelle wie eine mit Glycerin betriebene Batterie, um kleine elektronische Geräte wie Mobiltelefone oder Laptops aufzuladen.Es kann in Gebieten eingesetzt werden, die nicht vom Stromnetz abgedeckt sind.Später kann die Technologie für den Betrieb von Elektrofahrzeugen und sogar für die Stromversorgung von Haushalten angepasst werden.„Auf lange Sicht gibt es unbegrenzte Anwendungsmöglichkeiten“, sagte der Chemiker Felipe de Moura Souza, Erstautor des Artikels.Souza hat ein direktes Promotionsstipendium der São Paulo Research Foundation – FAPESP.
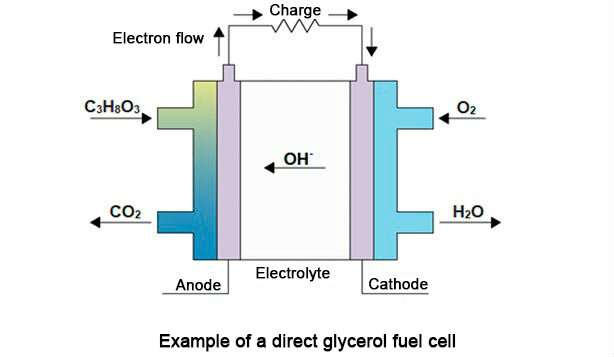
In der Zelle wird die chemische Energie aus der Glycerinoxidationsreaktion in der Anode und der Luftsauerstoffreduktion in der Kathode in Elektrizität umgewandelt, wobei als Rückstände nur Kohlenstoffgas und Wasser zurückbleiben.Die vollständige Reaktion ist C3H8O3 (flüssiges Glycerin) + 7/2 O2 (Sauerstoffgas) → 3 CO2 (Kohlenstoffgas) + 4 H2O (flüssiges Wasser).Eine schematische Darstellung des Prozesses ist unten dargestellt.
„Niob [Nb] ist als Co-Katalysator an dem Prozess beteiligt und unterstützt die Wirkung des Palladiums [Pd], das als Brennstoffzellenanode verwendet wird.Durch den Zusatz von Niob lässt sich der Palladiumanteil halbieren, was die Kosten der Zelle senkt.Gleichzeitig wird die Leistung der Zelle deutlich gesteigert.Aber sein Hauptbeitrag ist eine Verringerung der elektrolytischen Vergiftung des Palladiums, die aus der Oxidation von Zwischenprodukten resultiert, die im Langzeitbetrieb der Zelle stark adsorbiert werden, wie etwa Kohlenmonoxid“, sagte Mauro Coelho dos Santos, Professor an der UFABC , Dissertationsberater für Souzas direkte Promotion und Hauptforscher der Studie.
Aus ökologischer Sicht, die mehr denn je ein entscheidendes Kriterium für technologische Entscheidungen sein sollte, gilt die Glycerin-Brennstoffzelle als vorteilhafte Lösung, da sie mit fossilen Brennstoffen betriebene Verbrennungsmotoren ersetzen kann.
Zeitpunkt der Veröffentlichung: 30. Dezember 2019